FORMATION CHIMIE DES POLYMERES :
LA REACTION D'HYDROSILYLATION OU MODIFICATION CHIMIQUE DES SILICONES OU POLYSILOXANES
(Retour à l'index)
(Texte extrait de la thèse de P. CANCOUËT avec l'accord de l'auteur)
La réaction d'hydrosilylation consiste en l'addition d'une fonction
hydrogénosilane (Si-H) sur un composé organique insaturé comme le
montre le tableau III-1.
Groupement
insaturé |
Catalyseur
d'hydrosilylation |
Produit
d'hydrosilylation |
Référence |
>C=O |
[H2PtCl6 , 6 H2O]
RuCl2 (PPh3)2 |
>CH-O-Siº |
(203-205)
|
>C=N- |
ZnCl2 |
>CH-N-Siº |
(206,207) |
- CºN |
Acétylacétonate
de cuivre |
-CH=N-Siº |
(208) |
-N=O |
[H2PtCl6 , 6 H2O] |
-NH-O-Siº |
(209) |
-CºC- |
[Ph4As]2 [PtCl6] |
-CH = C-Siº |
(210) |
>C=C< |
[H2PtCl6 , 6 H2O] |
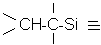 |
(217) |
Tableau III-1 : Différents types de fonctions insaturées concernées par l'hydrosilylation.
L'addition de fonctions hydrogénosilane sur les insaturations
éthyléniques est celle qui a fait l'objet du plus grand nombre de
travaux. C'est aussi celle qui nous intéresse puisque nous nous
proposons de greffer l'AEP sur des copolymères MD H n D m M.
Il existe principalement deux méthodes pour mettre en œuvre cette réaction :
„ La génération de radicaux silyle : thermiquement ( 300°C ) (211) ,
par irradiation (rayonnement U.V. (212) et g (213) ) ou par
décomposition de peroxydes (214) ou d'azonitriles
(215) . Cette technique est peu utilisée, car elle donne de nombreux
produits secondaires (télomérisation des composés insaturés,
décomposition des amorceurs) et des rendements faibles (216) .
„ La catalyse par des métaux de transition généralement du groupe
VIII. Parmi ces différents catalyseurs employés pour la réaction
d'hydrosilylation, les composés à base de platine et plus
particulièrement l'acide hexachloro-platinique hexahydraté sont ceux
qui présentent la plus grande efficacité comme l'ont montré Speier et
al. (217) . Ce catalyseur utilisé en très faible quantité et pour des
temps de réaction généralement inférieurs à 5 h permet d'atteindre des
rendements relativement élevés. Ce sont toutes ces raisons qui nous ont
conduit à l'utiliser pour nos synthèses.
III.2.1 L'acide hexachloroplatinique hexahydraté (ACP)
Sous sa forme commerciale, l'acide hexachloroplatinique hexahydraté
[H2PtCl6 , 6 H2O] (ACP) est un solide rouge-orangé, très hygroscopique,
ce qui rend sa manipulation assez délicate. N'étant pas soluble dans
les solvants usuels (hydrocarbures aliphatiques ou aromatiques) et
étant très peu efficace en phase hétérogène, il est généralement
utilisé en solution dans un alcool : l'isopropanol (163,218) ou le
tertiobutanol (219) , plus rarement dans du THF (220) . Lorsqu'il est
dissous dans l'alcool isopropylique, il prend le nom de catalyseur de Speier (217)
. Il s'avère efficace, selon les espèces chimiques mises en jeu, à très
faible concentration (jusqu'à 5.10 -8 mole par mole d'oléfine, dans
certains cas (221) ).
III.2.2 Mécanismes de l'hydrosilylation en présence d'ACP
III.2.2. 1 La période d'induction
En général, une fois les réactifs introduits dans le
réacteur (hydrogénosilane, oléfine et catalyseur de Speier), la
réaction d'hydrosilylation ne démarre pas immédiatement : elle présente
une période d'induction (163,218,222-227) . Cette période de durée
variable et qui peut atteindre plusieurs heures suivant les conditions
expérimentales laisse ensuite place à la réaction d'hydrosilylation qui
débute rapidement et de façon très exothermique. Nous avons trouvé dans
la littérature plusieurs interprétations différentes pour expliquer
cette période d'induction (163,218,222-227) . Lors de l'étude du
greffage par hydrosilylation des doubles liaisons pendantes du
polybutadiène par un aminosilane en présence d'ACP, Hazziza et al. (163,218)
ont démontré l'influence de l'ordre d'introduction des réactifs sur la
période d'induction. Ainsi, lorsque le catalyseur est ajouté après
l'oléfine et l'hydrogénosilane, on observe une période d'induction
dépendant de la concentration en catalyseur. En revanche, si le
catalyseur est laissé en contact avec le polybutadiène pendant une
période minimale de 15 min avant l'addition du silane, cette période
d'induction disparaît comme le montre la figure III-1.

Figure III-1 : Influence
du temps de contact (tc) entre l'ACP et le polybutadiène (PB),
précédant l'addition de l'aminosilane, sur la période d'induction
(163,218) .
a) tc = 0 ; b) tc = 15 min. ; c) tc = 40 min.
[ACP] = 9,7. 10 - 4 M ; [CH=CH2] = 0,66 M ; [SiH]o = 0,338 M ; T = 80°C .
Les auteurs ont admis que, dans l'isopropanol,
l'espèce catalytique principale est probablement un complexe
dinucléaire stabilisé par du propène
[(C3H6)PtCl2 ] 2 en
équilibre avec H[(C3H6)PtCl3 ] (226) . La période d'induction
résulterait de la nécessité d'une complexation préalable du platine par
les doubles liaisons pendantes du polybutadiène selon l'équilibre
suivant :
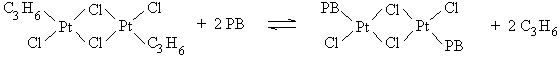
III.2.2. 2 Mécanismes de l'hydrosilylation en phase homogène
Bien qu'il puisse y avoir hydrosilylation lorsque le catalyseur est
en phase hétérogène, nous n'aborderons que les mécanismes de cette
réaction en phase homogène. Le mécanisme d'hydrosilylation le plus
classique reste celui proposé par Chalk et Harrod (225) (figure III-2).
Après complexation du platine par les doubles liaisons (période
d'induction), il y a addition oxydative d'une fonction hydrogénosilane
sur l'atome de platine qui passe ainsi du degré d'oxydation 2 au degré
d'oxydation 4.
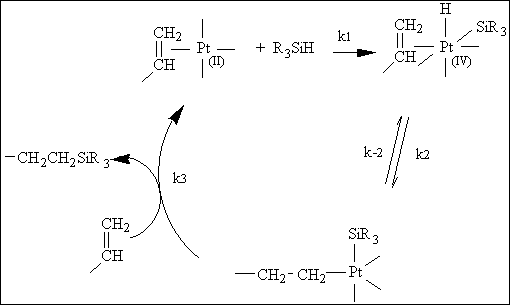
Figure III-2 : Mécanisme de l'hydrosilylation catalysée par l'acide hexachloroplatinique d'après Chalk et Harrod (225) .
Récemment, Hazziza et al. (218) ont étudié le mécanisme de
l'hydrosilylation dans le cas particulier d'un aminosilane et du
polybutadiène. Une étude cinétique a permis de distinguer deux cas
selon que la concentration en fonction hydrogénosilane est nettement
inférieure à celles des doubles liaisons (figure III- 3 a , b, c, d) ou
que les deux concentrations sont équivalentes (e). La figure III-3
illustre bien ce phénomène qui se traduit par une nette accélération
dans le cas où les concentrations sont les mêmes (e). Cette forte
accélération serait la conséquence de la réduction par la fonction
hydrogénosilane du Pt (IV) en Pt (0) , ce dernier ayant une activité
catalytique nettement supérieure. D'autre part, cette réduction du Pt
(IV) serait autocatalysée par le Pt (0) déjà formé. Ensuite, il y
aurait coordination d'un ligand oléfinique sur le Pt (0) , suivie d'une
addition du silane sur cette double liaison activée.
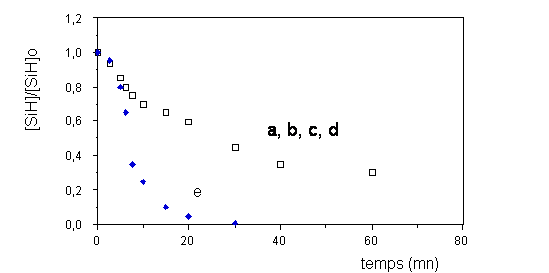
Figure III-3 : Influence de la concentration en SiH sur le déroulement de la réaction entre le polybutadiène et un aminosilane (218) .
[H2PtCl6 ,6 H2O] = 9,7.10-4 M ; [CH=CH2 ] = 0,66 M ; tc = 15 min ; T = 80 °C .
a) [SiH]o = 0,038 M ; b) [SiH]o = 0,058 M ; c) [SiH]o = 0,082 M ;
d) [SiH]o = 0,099 M ; e) [SiH]o = 0,660 M .
III.2.3 Les réactions secondaires
De nombreux travaux font état de réactions secondaires qui se
produisent lors de réactions d'hydrosilylation. Bien que des efforts
soient faits dans ce domaine pour tenter de les décrire, ces
phénomènes, divers et spécifiques à chaque cas, ne sont pas encore tous
bien compris. Nous nous limiterons, dans ce paragraphe, aux réactions
mises en évidence dans des systèmes proches du nôtre.
III.2.3. 1 Isomères d'addition de l'hydrogénosilane sur l'oléfine et isomérisation de l'oléfine
L'hydrosilylation des oléfines terminales catalysées par des dérivés
du platine conduit le plus souvent à une orientation de type
anti-Markownikov, ce qui correspond à une addition du silane en
position terminale par rapport à l'insaturation (position 1) et conduit
à un produit que l'on nomme habituellement adduct b . Cependant, dans
certains cas, le silane peut s'additionner partiellement en position 2
et donner un adduct a (163,216,222,225,230) comme le montre la
figure III-4 :
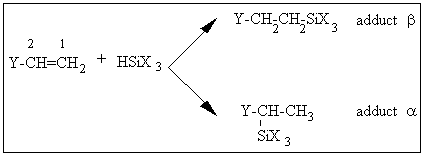
Figure III-4 : Isomères d'addition d'un hydrogénosilane sur une double liaison terminale.
Selon R.N. Neals (230) , les proportions des deux
types d'adducts dépendent non seulement de la nature des substituants X
et Y, mais également de la concentration du catalyseur.
Les alcènes 1,2-disubstitués résultant de
l'isomérisation des composés allyliques conduisent à la formation
d'adducts b ' (figure III-5) (163) . Harrod et Chalk (225) évoquent des
raisons cinétiques, résumées dans la figure III-5, pour expliquer que
les proportions de produits isomères ( b, a, b ') varient avec la
nature de l'hydrogénosilane. Des valeurs des constantes d'équilibre et
des constantes de vitesse dépendront les proportions de chacun des
isomères.
Lors de l'étude des réactions secondaires
intervenant dans le système 1-allyloxy 2-hydroxy 3-phénoxypropane (AHP)
/ a,w -dihydrogénoPDMS / ACP, Torrès (219) a mis en évidence une
réaction d'isomérisation de l'oléfine. L'auteur a pu montrer que cette
réaction dépendait de l'ordre d'introduction des réactifs. Le fait
d'introduire le catalyseur en dernier défavoriserait cette réaction
d'isomérisation et, d'une manière générale, les autres réactions
secondaires. A l'inverse, le mode opératoire consistant à mélanger
d'abord le composé allylique avec le catalyseur (ACP), puis à
introduire les fonctions hydrogénosilane goutte à goutte favoriserait
l'isomérisation et les autres réactions secondaires.
Cependant, il n'a pas pu être mis en évidence que
cette réaction d'isomérisation dépendait du rapport R = [ACP]/[SiH] ou
[ACP]/[allyl]. En effet, pour un rapport R < 10-4 , seule la
réaction d'isomérisation se produit, alors que pour un rapport R >
10-4 , les isomères 2-propényliques seraient consommés par une autre
réaction secondaire faisant intervenir les fonctions hydroxyle
secondaires de l'AHP. De plus, Torrès a constaté que ces isomères
2-propényliques de l'AHP n'étaient pas actifs vis-à-vis de
l'hydrosilylation.
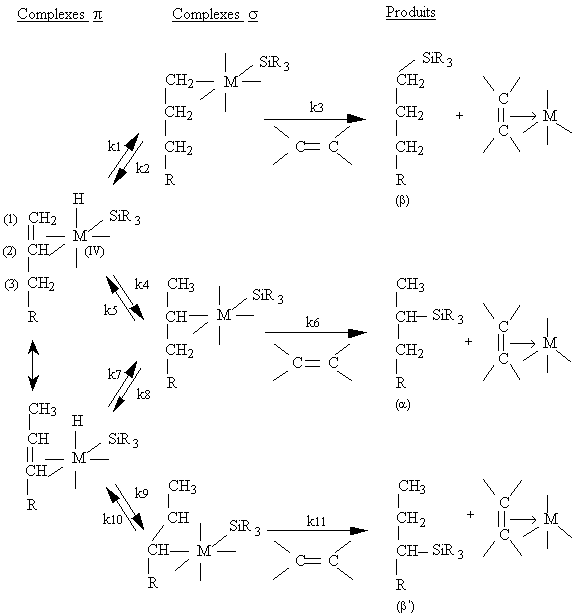
Figure III-5 : Cinétique d'isomérisation et d'hydrosilylation des oléfines proposée par Harrod et Chalk (225) .
III.2.3.2 Coupures des liaisons Si-CH3 et Si-H
Certains auteurs (231) décrivent des cas de coupures de la liaison
Si-C en présence d'un alcool et d'un catalyseur à base de palladium ou
de platine Dans le cas du PDMS, le schéma réactionnel est représenté
par la figure III-6 :
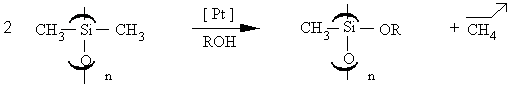
Figure III-6 : Coupure des liaisons Si-CH3 en présence de H2PtCl6 et d'alcool.
De la même façon que pour les liaisons Si-CH3 , des
coupures de liaisons hydrogénosilane peuvent se produire (232) . Ces
coupures catalysées par le platine en présence d'oxygène conduisent à
la formation de ponts siloxane et d'hydrogène (figure III-7).

Figure III-7 : Coupures de fonctions hydrogénosilane en présence de platine et d'oxygène et formation de ponts siloxane.
III.2.3. 3 Réactions secondaires liées à la présence d'alcool
L'utilisation d'un alcool pour solubiliser l'acide
hexachloroplatinique permet une catalyse homogène. Toutefois des effets
parasites peuvent en résulter :
Une condensation entre la fonction hydrogénosilane et la fonction alcool (233) :
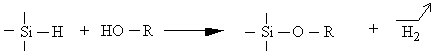
La formation d'acide chlorhydrique (234) :
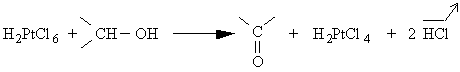
En fin de réaction d'hydrosilylation, certains
auteurs introduisent dans le mélange réactionnel un poison de
catalyseur. Celui-ci a pour but d'empêcher certaines réactions
parasites catalysées par les dérivés du platine. Pour l'ACP, le
bis-(1,2-diphénylphosphino)éthane en solution dans le toluène a été
utilisé avec succès (235) : Cependant, l'auteur ne précise pas si le
poison peut être éliminé ultérieurement.
Ces quelques rappels bibliographiques sur la
réaction d'hydrosilylation catalysée par l'acide hexachloroplatinique
nous ont permis d'en dégager les caractéristiques essentielles, les
limites, et surtout les réactions secondaires qui peuvent se produire.
En l'occurrence, nous avons vu que le fait de mettre en contact
préalablement l'oléfine et le catalyseur en l'absence du silane
supprimait le temps de latence, mais pouvait favoriser certaines
réactions secondaires. En revanche, la suppression de ce temps de
latence est nécessaire à toute étude cinétique visant à déterminer les
ordres réactionnels, donc le mécanisme.
Les réactions parasites peuvent en partie être
évitées en utilisant des réactifs et des solvants purifiés et séchés et
en opérant sous atmosphère inerte (argon). Enfin, pour la même espèce
catalytique de départ et étant donné la diversité des bilans
réactionnels observés dans la littérature, nous pouvons dire que les
résultats obtenus pour chaque système dépendent à la fois de l'oléfine,
du silane, de la nature du solvant, de la concentration des réactifs et
du catalyseur, de la température, mais aussi de l'ordre d'introduction
des réactifs.
III.3.6 Approche du mécanisme réactionnel (Nouveau mécanisme réactionnel selon P. CANCOUËT)
La synthèse des résultats de l'étude cinétique précédente conduit à écrire la vitesse de la réaction d'hydrosilylation :
v = k . [SiH]1/2 . [-CH=CH2]1 . [H2PtCl6]1 [10]
Le résultat le plus surprenant est l'observation d'un ordre 1/2 en
SiH. Pour l'expliquer, il faut envisager que deux molécules de produits
d'hydrosilylation soient formées à partir d'un seul intermédiaire. Cela
nous a amené à supposer que cet intermédiaire pouvait être un complexe
binucléaire du platine et que les deux atomes métalliques pouvaient
être actifs simultanément par réaction avec deux liaisons
hydrogénosilane voisines (n'oublions pas que le réactif est un
polymère). En nous inspirant du mécanisme de Chalk et Harrod dans
lequel une étape déterminante est l'insertion oxydative du platine dans
la liaison Si-H, nous pouvons envisager une réaction du type de
l'équation [11] :
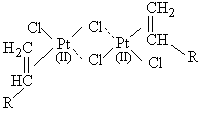 + H-Siº ®
+ H-Siº ® 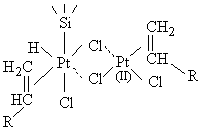 [11]
[11]
Nous remarquons alors - et cela est confirmé par la construction de
modèles moléculaires tels que celui qui est représenté sur la figure
III.19 - que la liaison
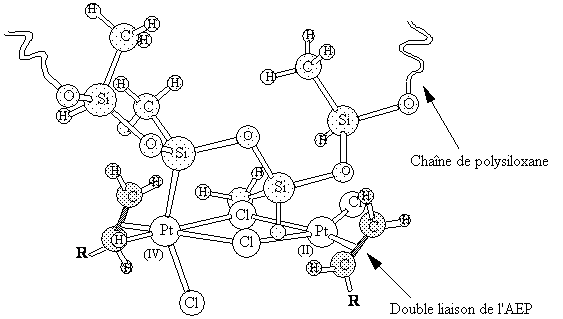
Figure III-19 : Modèle moléculaire du complexe
dinucléaire formé par insertion d'un atome de platine appartenant à un
complexe binucléaire dans une liaison Si-H d'une chaîne de
poly(hydrogénométhylsiloxane). Noter la proximité de la liaison Si-H du
motif voisin et du second atome de Pt.
Si-H du motif voisin se trouve à très courte distance de l'atome de
platine (II) du complexe binucléaire. On peut alors penser que la
deuxième réaction d'insertion oxydative se produit très facilement,
conduisant éventuellement à une dissociation du complexe binucléaire
(éq. [12]).
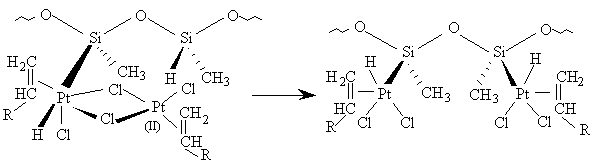 [12]
[12]
Le réarrangement de ce double intermédiaire réactionnel consisterait
en une insertion de la double liaison entre l'hydrogène et le métal,
suivie de la libération du produit d'hydrosilylation par élimination
conjointe du groupe alkyle et du groupe silyle et reformation de
platine divalent (éq. [13]) :
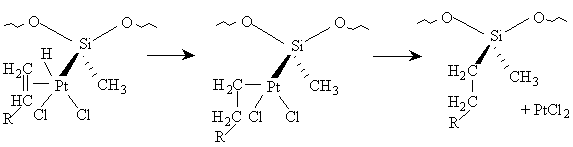 [13]
[13]
Il est facile d'adapter un tel schéma réactionnel pour qu'il rende
compte des ordres cinétiques observés. Nous pouvons considérer la suite
d'équilibres suivants :
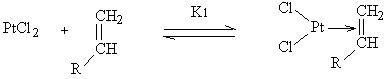 [14]
[14]
Pt Pt, cpx
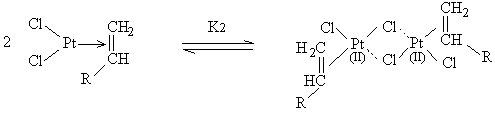 [15]
[15]
Pt, cpx Pt2
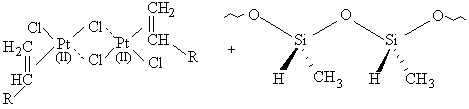
Pt2SiH
 [16]
[16]
HPt 2 Si
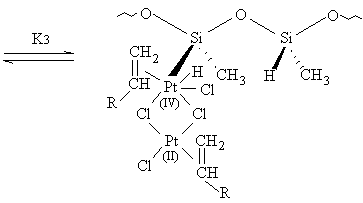
 HPt2Si2HPtSi
HPt2Si2HPtSi
[17]
N.B. Les noms indiqués sous chaque formule sont des notations simplifiées destinées à alléger l'écriture.
Le complexe HPtSi réagirait alors de la façon indiquée par
l'équation [13] avec une constante de vitesse k, cette étape étant
irréversible et cinétiquement déterminante. On peut alors écrire :
v = k [HPtSi] [18]
Compte tenu des équilibres représentés par les équations [14] à [17] :
il vient v = k K41/2 [HPt2 Si]1/2
v = k K4 1/2 K31/2 [Pt2 ]1/2 [SiH]1/2
v = k K4 1/2 K31/2 K21/2 [Pt, cpx] [SiH]1/2
v = k K 4 1/2 K3 1/2 K2 1/2 K1 [Pt] [C=C] [SiH]1/2 [23]
Si l'on admet que les constantes d'équilibre K1 , K2 et K3 sont
faibles, la plus grande partie du platine se trouve sous forme de
Pt(II) mononucléaire inactif et l'équation [23] est conforme à
l'équation de vitesse expérimentale.

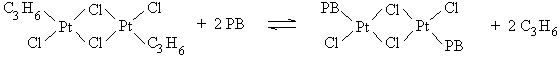




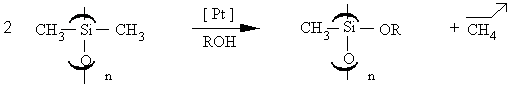



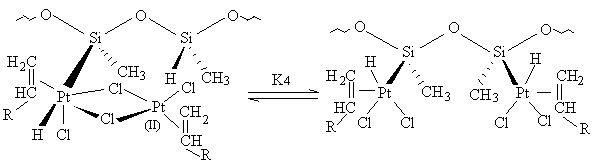
 + H-Si
+ H-Si [11]
[11] 
 [12]
[12]  [13]
[13]  [14]
[14]  [15]
[15] 
 [16]
[16]  HPt2Si2HPtSi
HPt2Si2HPtSi